енергія активації
ТЕОРЕТИЧНА ЧАСТИНА
Хімічна кінетика - це наука про швидкостях і механізми хімічних перетворень, про явища, які супроводжують ці перетворення, і про фактори, що впливають на них.
Механізм реакції - це послідовність стадій, пропонована на підставі експериментально встановлених даних про швидкість реакції і на експериментально виявлених інтер-Медиатим реакції (проміжних продуктах).
Кінетика за способом опису хімічних реакції ділиться на два розділи. У формальної або феноменологічної кінетиці сформульовані закономірності, що дозволяють описувати хімічну реакцію макроскопічно на основі експериментальних даних. Молекулярна кінетика вивчає перетворення на основі молекулярних даних про властивості частинок.
Теоретичну основу хімічної кінетики складають теорії зіткнень і перехідного стану.
Теорія зіткнень дозволяє пояснити вплив концентрації та температури на швидкості реакцій.
Теорія перехідного стану розглядає зміну в геометричному розташуванні атомів реагуючих молекул як єдиної системи.
Перехідним станом або активованим комплексом називається критична конфігурація, якої відповідає максимум потенційної енергії вздовж координати реакції.
Реагують молекули, які досягають цієї критичної конфігурації, утворюють молекули продуктів.
Кінетичні дослідження дозволяють визначити порядок і константу швидкості реакції, число і характер проміжних продуктів, енергію активації реакції, з'ясувати вплив природи розчинника, встановити характер і число зв'язків, що розриваються в ході реакції і т.п.
Розглянемо основні поняття хімічної кінетики.
1.1 Швидкість, константа швидкості, порядок і молекулярної хімічної реакції
З плином часу в процесі хімічної реакції відбувається зміна кількостей вихідних речовин і продуктів реакції. Ці зміни можуть бути різними через різні стехиометрических коефіцієнтів у речовин, які беруть участь в хімічній реакції. Тому, при розгляді швидкості реакції введені два поняття: швидкість реакції по даної речовини і швидкість реакції в цілому (просто швидкість реакції).
Швидкістю реакції називається зміна кількості i-того речовини (в молях) в одиницю часу в одиниці реакційного простору R:
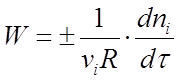 (1)
(1)
де ni - число молей i-го речовини, витрачений або отримане в ході реакції.
Це визначення швидкості є найбільш загальним. Воно справедливо для будь-яких умов, в тому числі і для неізотермічних.
Якщо реакція гетерогенна і протікає на кордоні розділу фаз, то реакційним простором є поверхня (R = S), і зміна кількості речовини відноситься до одиниці поверхні. Якщо реакція гомогенна і протікає в обсязі, то реакційним простором є обсяг (R = V). Зміна кількості речовини розглядається в одиниці об'єму. За умови V = const вираз (1) набуває вигляду 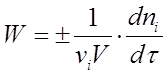 (2)
(2)
Якщо врахувати, що ni / V = Сi, тоді замість (2) отримаємо
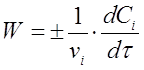 (3)
(3)
де vi - стехиометрический коефіцієнт перед i-тим речовиною в рівнянні хімічної реакції;
Сi - концентрація i-того речовини, моль / л;
τ - час реакції, с.
В даному випадку швидкість хімічної реакції чисельно дорівнює зміні концентрації одного з реагуючих речовин в одиницю часу.
З рівняння (3) випливає, що швидкість реакції завжди позитивна. Похідна d Сi / d τ характеризує швидкість реакції по даної речовини. Вона має від'ємне значення для вихідних речовин речовин, так як їх концентрація в ході реакції зменшується, і позитивне для продуктів реакції. Їх кількість протягом часу зростає.
Основним законом хімічної кінетики є закон діючих мас, що виражає залежність швидкості хімічної реакції від концентрації реагуючих (вихідних) речовин, який записують у вигляді
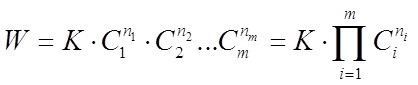 (3)
(3)
де К - коефіцієнт пропорційності або константа швидкості хімічної реакції, що чисельно дорівнює швидкості даної реакції при рівності одиниці концентрацій всіх вихідних речовин;
n1, n2, .... nm - показники ступеня - порядки реакції за індивідуальними речовин;
C1, С2, .... Сm - концентрації речовин, які беруть участь в даній реакції;
П - твір.
Константа швидкості хімічної реакції залежить від природи реагуючих речовин, температури і факторів, що впливають на протікання реакції.
суму
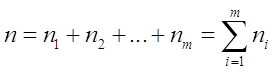
називають порядком хімічної реакції, тобто порядок хімічної реакції дорівнює сумі показників ступеня концентрацій реагентів в кінетичному рівнянні реакції і є експериментальною величиною.
Порядок по даної речовини (приватний порядок) визначається як показник ступеня концентрації цієї речовини в рівнянні для швидкості реакції.
Мoлекулярность хімічної реакції дорівнює числу вихідних молекул (або інших часток), які беруть участь в елементарному акті цієї реакції. При цьому число молекул продуктів реакції не має значення. Залежно від числа вихідних молекул розрізняють мономолекулярні, бімолекулярні і тримолекулярного реакції. Молекулярність реакції - поняття теоретичне.
Порядок і молекулярност' реакції збігаються тільки для простих реакцій, що протікають в повній відповідності з їх стехиометрическим рівнянням і законом діючих мас.
Порядок і молекулярност' реакції не збігаються, якщо:
- один з компонентів знаходиться у великому надлишку;
- реакція має складний механізм;
- на її перебіг впливають каталізатори або інгібітори.
розділ: хімія
Кількість знаків з пробілами: 21350
Кількість таблиць: 0
Кількість зображень: 2
... основні закономірностей активації LiAl, LixC6 і С8С3 електродів шляхом механічних, фізико-хімічних і електрохімічних впливів, а також ізучніе оборотної робота модифікованих електродів, що працюють за "принципом електрохімічного впровадження, в макетах літієвих акумуляторів. Завдання дослідження. Для досягнення поставленої мети потрібно було : -Провести комплексне систематичне ...
... можна судити з тих же позицій, які застосовуються в координаційній хімії для зв'язку метал-ліганд, для характеристики змін властивостей ліганда (тобто його активації). Основні поняття координаційної хімії В основі сучасних поданні про природу комплексів лежить координаційна теорія Вернера (1893 г.). Основні положення теорії А. Вернер вивів, розглядаючи сполуки, які або ...
... або кислот; так отримують, наприклад, золь гідроксиду заліза (III), який має наступну будову: {[Fe (OH) 3] mn FeO + · (n-x) Cl-} x + x Cl- 4.2.2 Агрегативна стійкість ліофобних колоїдів. Будова колоїдної міцели Ліофобні колоїди мають дуже високою поверхневою енергією і є тому термодинамічно нестійкими; це робить можливим мимовільний процес зменшення ...
...:, (2.8) де фотопровідність; - константа для даного зразка; - термічна енергія активації провідності (зазвичай 0,1-0,3 ев). Знак світлових носіїв струму у більшості органічних напівпровідників дірковий. Деякі адсорбовані пари і гази істотно змінюють фотоелектричні чутливість органічних напівпровідників. Залежність фотоструму від освітленості виражається ...